审批时限缩至30天!CDE新政+区域试点双轮驱动,细胞治疗进入普惠倒计时
本月,我国细胞治疗领域再迎新利好:9月8日,国家药监局药品审评中心(CDE)发布《先进治疗药品(ATMPs)沟通交流中I类会议申请及管理工作细则(征求意见稿)》,明确将细胞治疗产品审评时限缩短至30日,这一关键调整预计可使创新疗法整体上市周期压缩6-12个月。而仅仅4天前,国家卫健委正式表态支持横琴粤澳深度合作区开展干细胞技术先行先试。国家审批提速与区域创新实践相互呼应,标志着我国细胞治疗产业政策体系日趋完善,正全速驶入发展快车道。
▲示意图 | 来源网络
政策赋能:
构建全链条创新支持体系
CDE此次新政并非孤立举措,而是对2024年7月优化创新药临床试验审评审批试点的政策的延续与深化。数据显示,试点政策实施后已有4个项目按30日时限完成审批,较此前平均6-12个月的审评周期实现革命性突破。这种"精准滴灌"式的政策设计,通过突破性疗法、基因治疗和关键节点项目三类快速通道,实现资源最优配置。被纳入突破性治疗程序的产品不仅能获得优先技术指导,还能够显著降低研发中的不确定性,真正形成“提速不提险、增效更保质”的审评新机制。
▲示意图 | 来源网络
在国家战略指引下多地试点正逐步形成多元、互补的创新格局。广州南沙借助放宽市场准入政策,允许备案后的细胞治疗企业开展限制类技术临床应用,并配套1亿元奖励支持研发与转化;深圳前海依托外资准入试点,吸引如“深港细胞谷”等重点项目落地,推动深港在病毒载体、临床研究等方面协同合作;横琴合作区则以爱姆斯坦等项目为依托,探索“技术-监管-商业”一体化创新机制。这些区域试点共同构建出“国家战略引领-地方先行先试”多层次、网络化的政策支持体系。
技术突破:
从科研走向临床的关键跨越
细胞治疗技术正以惊人的速度实现从实验室走向临床的转化。2025年1月,国家药监局批准我国首款干细胞治疗药品艾米迈托赛注射液上市,成为本土干细胞领域里程碑事件。同期,首个遗传病基因治疗产品获批用于中重度血友病B成年患者,进一步印证了细胞治疗在罕见病领域的应用潜力。

▲示意图 | 来源网络
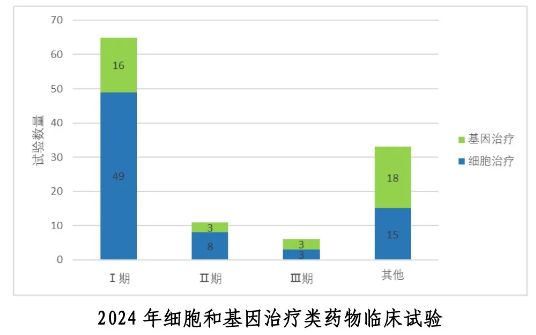
临床数据更能印证行业活力,2024年数据显示,我国新增细胞与基因治疗临床登记115项,共98款干细胞药物获准进入临床试验,其中当年年新增20款。治疗领域也从传统的血液肿瘤向领域扩展至实体瘤、自身免疫性疾病、神经退行性疾病等难治性疾病领域,值得关注的是,间充质干细胞药物(MSGs)已成为研究热点,相关临床项目较两年前增长近50%,为肝硬化、肺病等常见病治疗提供了新方向。
▲示意图 | 来源网络
产业重构:
迎接3000亿美元市场机遇
在政策红利与技术突破的双轮驱动下,细胞治疗产业正在迎来全球性增长契机。据预测,全球细胞再生医学市场规模将从2025年的566亿美元跃升至2035年的3015亿美元,中国市场年均增速预计达18.2%,成为亚太地区重要增长极。

▲示意图 | 来源网络
产业链结构日益完善:上游,粤港澳大湾区临床级种子细胞库已投入使用,为帕金森病、糖尿病等疾病提供标准细胞治疗方案;中游,南沙生物治疗健康效应评价中心整合单细胞测序、AI预警等前沿技术,建立国际先进的疗效与安全评估平台;下游,商业支付方式创新与适应症拓展共同推动治疗可及,CAR-NK等新一代疗法在实体瘤等领域表现出更好耐受性与疗效,进一步助推技术普及与价格下沉。
未来展望:
从高价定制走向全民普惠
随着政策支持深化与技术迭代加速,细胞治疗正从罕见病向常见病、从晚期治疗向早期干预延伸。人工智能和大数据技术的深度融合,将进一步赋能细胞治疗发展。AI驱动的工具可用于预测和评估治疗风险与效果,推动治疗全流程标准化管理,为全球提供“中国方案”。
“细胞治疗的黄金时代已然来临。”正如国家卫健委答复中所言,我国正以政策创新为帆、技术突破为桨,在细胞治疗这片蓝海破浪前行。当“活细胞药物”真正实现大众可及时,医疗的边界将被彻底改写,更多患者将迎来治愈希望。


 扫一扫,关注我们
扫一扫,关注我们
