外泌体分离纯化:从实验室到产业的技术革新
外泌体作为生物医学领域的 “明星分子”,在疾病诊断、药物递送和再生医学等方面展现出巨大潜力。而外泌体的分离与纯化,正是解锁其价值的关键一步。从实验室的科研到工业化的规模生产,一系列高效技术正让外泌体的获取变得更精准、更高效、更可控。

外泌体的分离技术主要依据其固有的物理化学属性,涵盖尺寸大小、质量分布、表面特有的蛋白质标记、表面电荷以及密度差异等特征。目前科研领域主流分离提取方法有超速离心法、密度梯度离心法、超滤法、免疫磁珠法、聚合物沉淀法、分子排阻法、阴离子交换层析及微流控芯片法等。下表简单列举不同外泌体分离纯化方法的原理及优缺点:

▲表1 | 常用外泌体分离纯化技术汇总
外泌体制备方法众多,根据制备样本的体量和最终的应用场景,可以选用不同的外泌体制备方法。

超速离心法因其纯度高、操作标准化,被公认为外泌体提取的“金标准”。其制备流程如下:
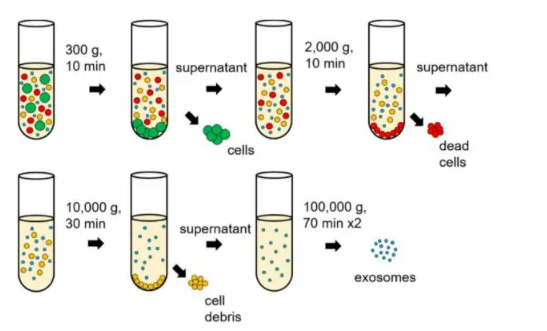
▲超速离心法分离外泌体流程
具体步骤:
①样品前处理
从细胞上清中分离外泌体:收集细胞悬液,先300g离心10min,将细胞和培养上清分离;再2000g离心10min去除死细胞;离心上清转移至新管,10000g离心30min去除细胞碎片。
②超速离心
将预处理后的样品装入超速离心管,以100000g,4℃,离心70min;弃上清,用预冷PBS重悬沉淀,然后进行二次超速离心,即100000g,4℃,离心70min;弃上清,重悬底部沉淀即为外泌体。
③外泌体保存
短期4℃保存;-80℃长期保存,注意避免反复冻融。
超速离心分离外泌体虽然有其优势,但由于操作复杂耗时,离心的高转速可能损伤外泌体,且难以满足工业化大体系生产需求,因此工业化外泌体制备需采用新工艺流程。

在工业化生产中,外泌体由于分离和纯化难度较大,故外泌体的产量在一定程度上决定着临床应用的广泛性。目前细胞外泌体的分泌量难以满足工业化需求,需通过技术手段放大生产。研究表明,缺氧、饥饿、氧化应激、剪应力、加热、电刺激等处理都会增加外泌体产量。

工业化生产中,外泌体来源广泛,原料多以体液形式提供,含核酸、蛋白等杂质,要确保外泌体分离的通量、产出量和纯度是关键。目前外泌体领域已经从纯粹的科学研究转向了产业化,在工业化放大生产中主流方案如下:
方案一: 切向流过滤+离子交换
切向流过滤联合阴离子交换层析可实现大规模外泌体纯化,蛋白去除率超99.97%。
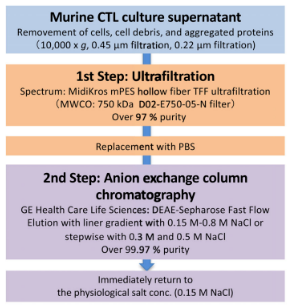
▲外泌体超滤-层析工艺流程
注:图片来源于《Distinguishing functional exosomes and other extracellular vesicles as a nucleic acid cargo by the anion-exchange method》
方案二: 排阻层析+离子交换法
①复合模式层析纯化:
使用Crysto shell 400(兼具阴离子交换与疏水功能)复合模式层析介质,吸附宿主细胞杂质,外泌体因分子量大被排阻在外直接流穿。(注:Crysto shell 400相比Capto Core 400孔径更小,可确保回收率。)
② 离子交换层析纯化:
使用MoSphere 70X DEAE/Q超大孔阴离子交换层析介质,进行外泌体的精纯。(注:MoSphere 70X DEAE/Q具有微米级孔径,载量更高,传质速度更快。)
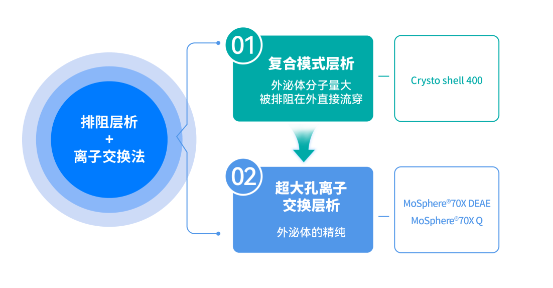
▲注:图片来源于科诺赛生物
方案三:疏水层析+离子交换法
① 疏水层析纯化:
使用Butyl Chromrose 4FF疏水层析介质,去除宿主细胞等杂质。
② 离子交换层析纯化:
使用MoSphere 70X DEAE/Q 超大孔阴离子交换层析介质,捕获外泌体。(注:MoSphere 70X DEAE/Q 具有微米级孔径,载量更高,传质速度更快。)
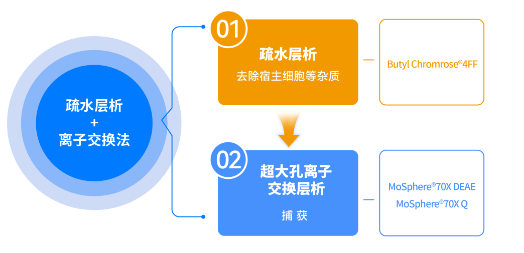
▲注:图片来源于科诺赛生物


 扫一扫,关注我们
扫一扫,关注我们
