我国首张干细胞药品处方落地,干细胞药品迈入商业化临床应用的新阶段
2025年6月5日,北京大学人民医院黄晓军院士团队开出全国首张艾米迈托赛注射液处方,标志着我国干细胞药物正式迈入商业化临床应用阶段。

▲示意图|来源网络
药品基本信息与用途
1. 药品名称与性质:
首款处方药品为“艾米迈托赛注射液”(商品名:睿铂生),是我国首个获批上市的间充质干细胞治疗药物,源自脐带组织,符合药品生产质量管理规范(GMP)标准。
2. 适应症与适用人群:
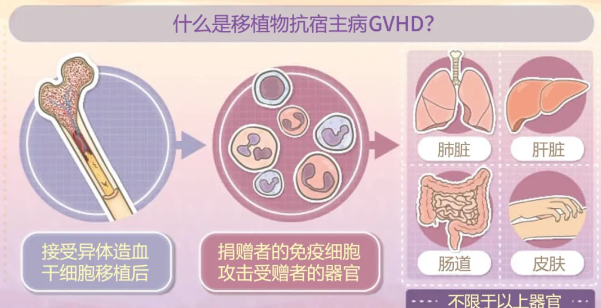
用于治疗14岁以上、激素治疗失败的急性移植物抗宿主病(aGVHD)患者,尤其以消化道受累为主。aGVHD是造血干细胞移植后的致命并发症,传统治疗失败后死亡率高。
▲示意图|来源网络
3. 药品售价:
19800元/次(一次处方一个疗程,共8次)。
▲示意图|来源网络
重要的里程碑意义
技术突破:从实验室到临床的跨越
艾米迈托赛注射液的研发历时12年,经历了严格的临床试验验证。2013年提交IND申请后,团队攻克了细胞采集、扩增、冻存等核心技术难题,于2020年启动随机双盲安慰剂对照II期临床试验,结果显示50%患者实现客观缓解(对照组34.2%),2年总生存率达71.1%。2023年III期关键性临床试验进一步验证了长期疗效,2024年获得全国首张干细胞药品生产许可证,仅用5个月便完成从获批到临床应用的跨越。

▲示意图|来源网络
该药物采用人脐带间充质干细胞作为来源,相较于美国已上市的骨髓间充质干细胞疗法Ryoncil,具有采集便捷、伦理争议小、适用人群精准等优势。其作用机制通过调节免疫微环境、促进组织修复,显著降低慢性GVHD发生率(2年累积发生率48.3%vs对照组64.2%),尤其对中度至重度患者效果突出。
临床价值:填补治疗空白
急性移植物抗宿主病是异基因造血干细胞移植后最严重的并发症之一,常规治疗以糖皮质激素为核心,但激素耐药患者预后极差。艾米迈托赛的上市为这一群体提供了全新选择。黄晓军院士团队将干细胞治疗与“北京方案”结合,构建了“移植+免疫调节”的全周期治疗体系,使患者不仅能活下来,更能实现高质量生存。

▲黄晓军院士团队 | 图片来源网络
行业影响:千亿市场的破局之战
弗若斯特沙利文数据显示,全球干细胞治疗市场规模已超250亿美元,中国正以每年30%的增速成为核心增长极。艾米迈托赛的上市标志着我国从“临床试验大国”向“创新药输出国”的转变。其成本控制优势和冷链运输能力,为后续产品商业化提供了范本。

▲示意图|来源网络
首张处方的背后,是中国科学家在生物医药前沿领域迈出的坚实一步。从实验室到临床,从技术突破到产业落地,首张干细胞药品处方的上市不仅是医学进步的见证,更是我国生物医药创新生态成熟的标志。随着干细胞伦理、定价机制等议题逐步明晰,这场由本土创新引领的医疗突破,正在重新定义重大疾病的未来治疗图景。


 扫一扫,关注我们
扫一扫,关注我们
