CGT产业链周刊 | 国产CAR-T细胞药物申报上市,价格仅20余万元!


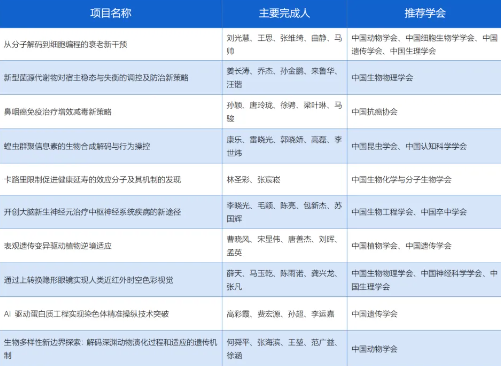
①重磅!2025年中国生命科学十大进展公布
近日,中国科协生命科学学会联合体开展年度“中国生命科学十大进展”评选,最终确定6个知识创新类和4个技术创新类项目成果为2025年度“中国生命科学十大进展”。这些进展近集中展现了我国科学家在衰老干预、免疫治疗、神经科学、AI驱动生物技术等领域的前沿突破,为全球生命科学研究注入中国力量。
②中检院发表细胞治疗监管30年的综述
近日,中检院在《Advances in Experimental Medicine and Biology》专题专著“Cell Therapy Manufacturing”,发表了题为“Development of Regulation and Policy for Cell Therapies in China”的综述文章,系统介绍了我国细胞治疗产品监管政策和质量评价体系的总体情况。文章概述了我国细胞治疗产品监管政策的发展历程和质量评估能力的提升路径,重点介绍了中检院在推动细胞治疗产品监管政策发展中的技术支撑作用。文章里程碑意义重大,它标志着、中国细胞治疗监管体系正从国际标准的“遵循者”向“共同制定者”转变。
③中国科学家团队发现调节性T细胞疗法可逆转动脉粥样硬化
近日,来自上海交通大学医学院郑颂国教授团队和中山大学附属第三医院钱孝贤团队联合在《MedComm》期刊发表研究,首次揭示诱导性调节性T细胞(iTregs)可通过抑制VSMCs向巨噬细胞样表型转化,显著减轻动脉粥样硬化病变。这一发现为心血管疾病的治疗开辟了细胞疗法新路径。
④中国首款上市干细胞药物睿铂生®关键期临床数据公布
2025年12月6日至9日,全球血液学领域最具影响力的年度盛会——第67届美国血液学会(ASH)年会在美国奥兰多隆重召开。大会上,铂生卓越公布了中国首款上市干细胞产品艾米迈托赛注射液治疗难治性急性移植物抗宿主病(SR-GI-aGVHD)的多中心、单臂、关键期临床研究结果。关键临床数据显示:第28天客观缓解率(ORR)达63.0%,完全缓解率(CR)为55.6%,疾病控制率(DCR)51.9%;第56天ORR和CR分别为51.9%和50.0%。中位无失败生存期(FFS)为65.5天,全分析集(FAS)第360天总生存率(OS)为65.8%。安全性良好,未报告输注毒性或药物相关严重不良事件。
⑤CAR-T细胞治疗实体瘤最新突破
2025年12月11日,国际权威期刊Cancer Cell(影响因子48.8)发表了一项重要研究成果,美国罗斯威尔帕克综合癌症中心(Roswell Park Comprehensive Cancer Center)科学家成功开发出一种搭载白细胞介素-36y(IL-36y)的“装甲”型CAR-T细胞疗法,在动物实验中不仅彻底清除了实体肿瘤,还激活了机体自身持久的抗肿瘤免疫反应。这项由CAR-T细胞疗法先驱、医学博士Renier Brentjens领衔的研究,首次揭示了通过改造CAR-T细胞来重编程中性粒细胞,从而打破实体瘤免疫抑制微环境的新机制。
⑥武汉大学中南医院细胞(生物)治疗门诊开诊
12月12日,武汉大学中南医院细胞(生物)治疗门诊正式揭牌开诊。门诊汇聚肾病内科、血液内科、风湿免疫科、耳鼻咽喉头颈外科、肝胆胰外科、移植医学中心等多学科核心专家力量,为患者量身打造“精准评估—个性方案—长期随访”的一站式诊疗服务。此举标志着该院在细胞治疗领域实现“诊疗一体化”服务升级,将通过多学科协作模式,让前沿生物治疗技术真正惠及更多患者。

①全球首款外泌体疗法III期临床数据公布
近日,Capricor Therapeutics宣布其在研外泌体细胞疗法Deramiocel在治疗杜氏肌营养不良症(DMD)的关键性III期临床试验HOPE-3中取得突破性成果。这项III期临床研究是一项多中心、随机、双盲、安慰剂对照试验,共纳入106名DMD患者,平均年龄约15岁,其中绝大多数已无法行走,并伴有严重心肌病。受试者每三个月接受一次静脉输注Deramiocel或安慰剂,持续一年。结果显示,该疗法不仅达到了主要终点——上肢功能评估量表PUL v2.0显示疾病进展速度比安慰剂组减缓了54%(p=0.029),还在关键次要终点左心室射血分数(LVEF)上表现出91%的疾病进展延缓(p=0.04),且安全性良好,与既往研究一致。
②新一代通用型CAR-T获批临床,针对自免疾病治疗
2025年12月12日,上海邦耀生物科技有限公司宣布,基于具有自主知识产权的通用型细胞平台(TyUCell®)开发的新一代异体UCAR-T产品“靶向CD19基因修饰的异体嵌合抗原受体T细胞注射液”针对中度或重度难治性系统性红斑狼疮(rSLE)的新药临床试验申请(IND),已于12月11日正式获得国家药品监督管理局药品审评中心(CDE)的默示许可。这是继异体UCAR-T产品在血液肿瘤领域实现双适应症突破后,邦耀生物在自身免疫疾病治疗领域的又一里程碑式进展。

①全球首例!In vivo CAR挑战肝癌一线治疗,完成首例患者给药
近日,CREATE Medicines(前身为 Myeloid Therapeutics)宣布其一线治疗转移性肝细胞癌(HCC)队列临床试验(NCT06478693)已完成首例患者给药。该研究旨在评估靶向GPC3 in vivo CAR疗法MT-303联合阿替利珠单抗与贝伐珠单抗的疗效,而后者正是当前一线治疗HCC的全球标准方案。此前MT-303在Ⅰ/Ⅱ期单药剂量递增试验中,已成功验证其可实现体内CAR表达、激活髓系细胞、促进肿瘤浸润,并具备临床活性和重复给药可行性,为其推进至联合治疗及早期治疗场景筑牢了基础。
②FDA批准首个干细胞疗法治疗重型再生障碍性贫血
美国食品药品监督管理局(FDA)正式批准Gamida Cell公司的同种异体脐带血细胞疗法Omisirge®(通用名:omidubicel-onlv)用于治疗重型再生障碍性贫血(Severe Aplastic Anemia, SAA)。这是全球首个获批用于SAA的细胞治疗产品,标志着这一罕见且危及生命的血液疾病迎来了革命性的治疗突破。
③一针仅20余万元!中国造CAR-T细胞药物申报上市
2025年12月12日,华道生物透露,已向国家药监局药品审评中心递交了其首款CAR-T细胞药物的上市申请。值得注意的是这款细胞新药定价仅23-25万元,远低于国际均价40万美元和国内120万元的同类产品。该药物针对难治复发性非霍奇金淋巴瘤,拥有完全自主知识产权,有望彻底改变患者“用不起”的困境。


 扫一扫,关注我们
扫一扫,关注我们
