CGT产业链周刊 | 药监+医保双政支持,干细胞疗法“合法+能报销”,正式迈入创新药医保通道!
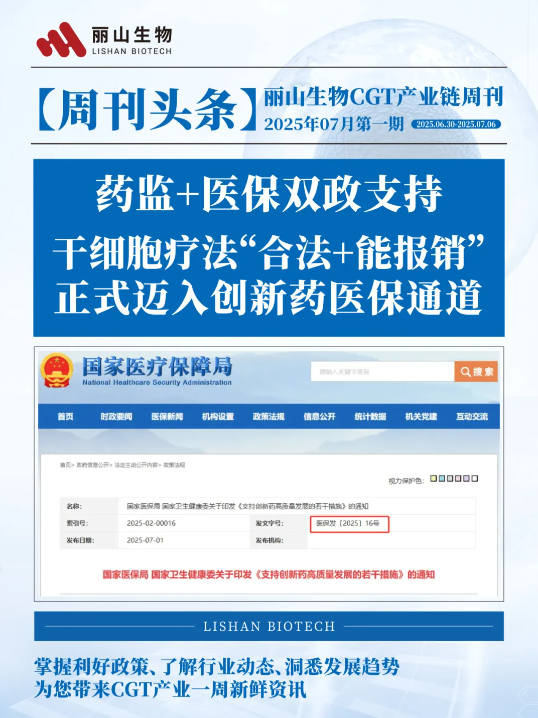

①药监+医保双政支持,干细胞疗法“合法+能报销”,正式迈入创新药医保通道!
6月30日,国家医保局与国家卫健委联合发布医保发〔2025〕16号文件——《支持创新药高质量发展的若干措施》(以下简称《若干措施》)。这份“顶层设计”一举推出涵盖研发、准入、临床应用、支付和监管等16项重磅举措,被业内称为创新药发展的“加速键”。对于正迈入商业化元年的干细胞疗法而言,《若干措施》不仅是利好政策,更是未来3-5年产业发展的路线图与任务书。
②药监局CDE发布《细胞治疗药品药学变更研究与评价技术指导原则(征求意见稿)》
7月1日,国家药品监督管理局药品审评中心(CDE)发布了《细胞治疗药品药学变更研究与评价技术指导原则(征求意见稿)》。这一指导原则旨在科学指导细胞治疗药品药学变更研究的开展,规范细胞治疗药品全生命周期的研究与管理,建立科学规范的审评技术标准。文件明确了变更研究的基本原则、风险评估方法及可比性研究技术要求,适用于自体/异体细胞治疗药品,如CAR-T、干细胞等。

①6月药监局受理 9 款细胞治疗新药:干细胞、功能细胞、免疫细胞三路齐发,北上深苏、成都长沙加速竞跑!
2025年6月,国家药监局药品审评中心(CDE)共受理9款细胞类治疗用生物制品的临床试验申请,涵盖3款间充质干细胞(MSC)、2款功能性体细胞药物和4款免疫细胞产品(CAR-T、CAR-NK、自体免疫细胞),呈现出“多赛道并进”的新格局。这也是继4月CDE密集发布细胞治疗技术指导原则后,国内细胞药进入加速通道的又一明确信号。
②干细胞治疗眼病视力改善持续36个月
在2025 年临床试验峰会(CTS)上,LineageCellTherapeutics(Lineage)公布了其与罗氏/基因泰克合作开发的异体干细胞疗法OpRegen(RG6501)治疗年龄相关性黄斑变性(AMD)继发的地理萎缩(GA)的I/a期临床试验(NCT02286089)36个月长期随访数据。结果显示,单次视网膜下给药RG6501后,GA患者的视力改善和视网膜结构修复效果可至少持续3年,为这一尚无有效疗法的致盲性疾病带来重大希望。

①全球首创!瑞顺生物CAR-DNT细胞疗法获重大突破:淋巴瘤患者多次给药后实现100%缓解
近日,广东瑞顺生物技术有限公司(以下简称 “瑞顺生物”)公布了其全球首款现货通用型 CD19-CAR-DNT细胞产品(RJMty19 注射液)在治疗B细胞非霍奇金淋巴瘤(B-NHL)领域的突破性临床进展。该成果不仅标志着中国细胞治疗技术在全球创新竞赛中实现从“跟跑”到“并跑”的跨越,更有望重塑血液肿瘤治疗的临床格局。
②中盛溯源iPS细胞疗法获突破:首例早发型帕金森病成功给药
2025年7月3日,据中盛溯源对外发布的公告,中盛溯源携手国内顶尖神经学科团队与开展的“评价同种异体多巴胺能神经前体细胞(iDAP)注射液治疗帕金森病的安全性、耐受性和初步有效性临床试验”迎来了重大突破——首例早发型帕金森病(EOPD)受试者顺利完成了给药!首位早发型帕金森病(EOPD)患者成功接受细胞移植。
③传奇生物通用型CAR-T治疗自免疾病一期临床启动
7月3日,传奇生物在Clinicaltrials.gov网站上注册了LUCAR-G19治疗自身免疫病的一期临床试验。该一期临床计划入组42例复发性或难治性自身免疫病患者,预计2028年初步完成。此次一期临床覆盖的适应症包括系统性红斑狼疮、系统性硬化症、ANCA相关血管炎、炎症性肌病、大动脉炎、IgG4相关疾病等。
④全球首个干细胞外泌体治疗肝衰竭临床研究正式启动
近日,全球首个干细胞外泌体治疗肝衰竭临床研究在南方医科大学珠江医院启动。该研究利用间充质干细胞来源的外泌体,具有抗炎、抗凋亡和促进组织再生能力,且安全性高、易于标准化生产。研究方案紧密围绕肝衰竭治疗的核心目标——提高生存率、改善肝功能进行展开:采用前瞻性的单臂设计,在标准内科综合治疗(包括人工肝支持治疗)的基础上,静脉输注PT-MSCs外泌体,剂量为1~2x10^11particles/剂(NTA检测),在第1、4、7天共输注3次,计划招募20例符合标准的肝衰竭患者。


 扫一扫,关注我们
扫一扫,关注我们
