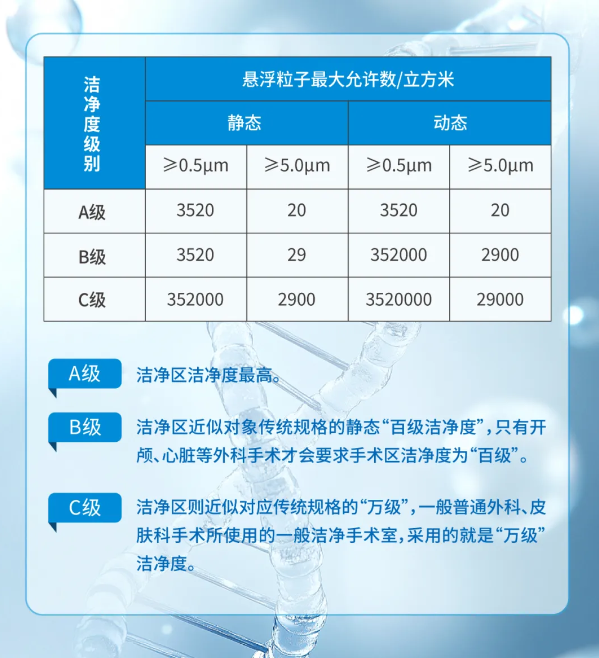
CDMO生产的“标准范式(二)”——GMP级生产车间的洁净标准
在细胞与基因治疗CDMO领域,GMP级生产车间的洁净标准是保障产品质量与安全性的核心。随着细胞与基因治疗产业全球化发展浪潮加速,对生产环境的微生物控制、粒子污染管理及工艺稳定性提出了更高要求。是否具有系统性的洁净管理体系和标准,成为衡量一个细胞与基因治疗CDMO企业能否长远发展的核心要素。

▲丽山生物CDMO实景图
历下控股投建,丽山生物独立运营的CDMO中试基地,作为山东省首家由省科技厅认可的免疫细胞与基因治疗CDMO中试基地。在产线设计,洁净等级严格执行GMP标准,打造纯B+A、C+A级的药用级研发生产环境,并严格执行规范的洁净标准和措施,为安全生产和高质量产品构筑了一道坚实的“防火墙”。

丽山生物CDMO中试基地,严格执行国家《药品生产质量管理规范》无菌生产标准,按照GMP标准建设五大生产中心。搭建B+A级、C+A等级的科研、生产环境,满足主流的细胞治疗产品生产解决方案。并采用行业首屈一指的先进单项流设计,高效的确保科研和生产过程的洁净无菌。

作为洁净体系中最活跃的变量,人员管理需要技术与制度的双重规范。丽山生物设有专门的参观走廊,与内部研发空间无接触完全隔离,密闭最大限度避免了交叉污染。

▲CDMO参观走廊
除此之外,进入实验室,秉承“非必要不进入,非专业人员不进入”原则,实验室制定了规范化出入流程,人员进入实验室必须按照标准要求洗手、束发,全身穿戴防护帽、防护口罩、防护服、手套、鞋套等隔离装备,从密度空间隔离措施到人员防护穿戴再到衣物一日一消毒,丽山生物事无巨细,将人员因素对洁净体系的影响降到最低,全方位确保生产研发空间的洁净无污染。
▲规范化出入流程

空气洁净之上,丽山生物斥资超千万引进国际领先的药用级独立循环水系统,4条注射用水、6条纯化水。注射水系统采用降膜式蒸发器,干式蒸馏法,能够去除所携带的热原和微粒子,最终产品(纯蒸汽)中内毒素含量低于0.01EU/ml,不凝性气体含量、干燥度、过热度三个指标符合HTM2010标准,保证实验和生产过程的完全高质量高合规。

▲独立循环水系统
GMP级生产车间的洁净标准是CDMO企业的核心竞争力。在产线标准之上,丽山生物将持续严苛基地洁净管控措施与日常规范,将洁净标准将向“零污染、全追溯、可持续”方向持续升级,高效赋能生物医药技术创新,为细胞与基因治疗产业技术提升筑牢根基。


 扫一扫,关注我们
扫一扫,关注我们
