细胞治疗又迈出关键一步:首款间充质基质细胞药物获批临床试验
2025年3月12日,中国创新药政体系迎来破冰时刻——国家药品监督管理局药品审评中心(CDE)批准了国内首款间充质基质细胞药物(NR-20201)的临床试验申请(IND)。这距离该药物去年10月26日斩获美国FDA临床试验批件仅五个月,意味着这款"中国智造"细胞药物同步获得全球两大药监体系的品质认可。也标志着中国在间充质基质细胞(MSCs)药物治疗领域迈出了重要一步。
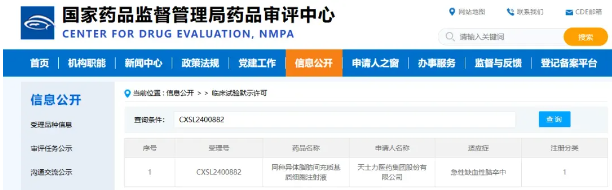
▲网站截图 | 来源网络

近年来,国家对新质生产力的要求日益明确,强调科技创新和高质量发展。在医药领域,推动医药产业从仿制药为主向创新药为主转型,特别是支持细胞基因治疗(CGT)等前沿技术的产业化。这场由企业发起的科学正名运动,倒逼监管体系开启认知升级。CDE在审批过程中展现了对先进疗法的科学认知和创新求变的监管理念,推动了细胞治疗药物监管审评体系的科学化与创新。
▲示意图 | 来源网络

长期以来,MSCs一直被误认为是干细胞。虽然有专家学者对其身份提出质疑,但国内并无企业使用“间充质基质细胞”这一名称进行申报,也没有基于间充质基质细胞的身份鉴定标准。这份来自于天士力医药集团的间充质基质细胞药物(NR-20201)的临床试验申请(IND)打破了长期以来的惯例。天士力干细胞研发团队通过单细胞转录组测序技术和轨迹分析程序,揭示了MSCs与干细胞在基因表达和功能上的根本差异,证明了MSCs不是干细胞!基于这种差异,天士力建立了一套全新的、有别于干细胞的间充质基质细胞鉴定标准。同时,他们发现MSCs具有不同于干细胞的作用机制,其进入人体后归巢到受损组织,与血管内皮细胞协同作用,激活受损组织血管再生和自主功能修复能力,由此创建了基于间充质基质细胞的临床治疗基本理论。这些都为MSCs药物的开发提供了全新的思路,也给监管机构带来了认知挑战。
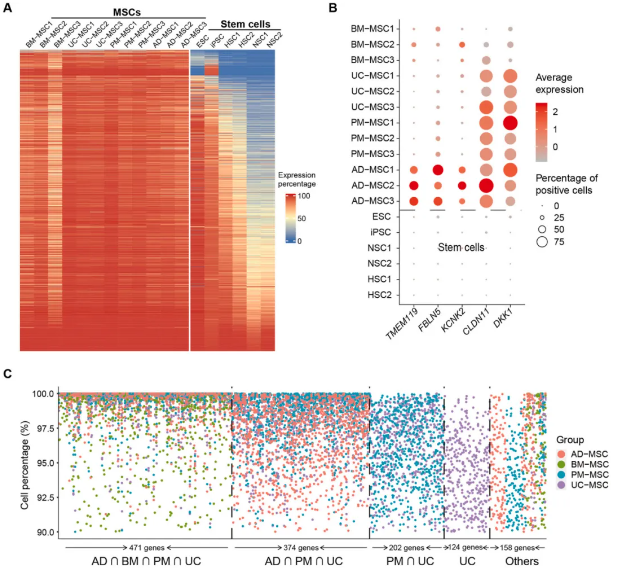
▲MSCs单细胞水平的功能基因分析 | 来源网络
随着中美两国在MSCs治疗领域相继取得监管突破,全球细胞治疗产业格局正在发生变化。CDE在审评过程中展现出的科学化、体系化思路,推动中国从全球细胞治疗领域的“重要参与者”向更具影响力的“行业引领者”迈进。此次NR-20201的获批,不仅体现了中国在细胞治疗领域的监管审评能力,也标志着中国在全球细胞治疗创新中走在了前列。
NR-20201的获批是中国细胞治疗领域的重要里程碑,展现了我国在细胞治疗药物监管审评体系方面的科学化与创新性。这一成就不仅为国内细胞治疗产业的发展注入了新的动力,也为全球细胞治疗产业的进一步发展提供了有益的经验和借鉴。


 扫一扫,关注我们
扫一扫,关注我们
