CGT产业链周刊 | 国家药监局批准我国首款干细胞治疗药品上市
重磅政策
1、CDE发布《腺相关病毒载体基因治疗产品非临床研究技术指导原则》,自发布之日起施行
2024年12月31日,国家药监局药审中心(CDE)发布《腺相关病毒载体基因治疗产品非临床研究技术指导原则》,自发布之日起施行。
2、CDE发布《嵌合抗原受体T细胞治疗血液淋巴系统恶性肿瘤临床试验技术指导原则(试行)》
2024年12月31日,国家药监局药审中心(CDE)发布《嵌合抗原受体T细胞治疗血液淋巴系统恶性肿瘤临床试验技术指导原则(试行)》,自发布之日起施行。
3、《上海市药品和医疗器械管理条例》通过,大力支持细胞和基因治疗!
2024年12月31日,《上海市药品和医疗器械管理条例》由上海市第十六届人大常委会第十八次会议表决通过,并将于2025年3月1日正式施行。
《上海市药品和医疗器械管理条例》以创新和服务为核心,通过制度化手段破解行业发展瓶颈,特别是在细胞和基因治疗等前沿技术领域提供了前所未有的支持。
未来,这部法规的落地实施不仅将巩固上海在生物医药领域的领先地位,也将为中国整体生物医药产业的发展开辟新的篇章。
行业动态
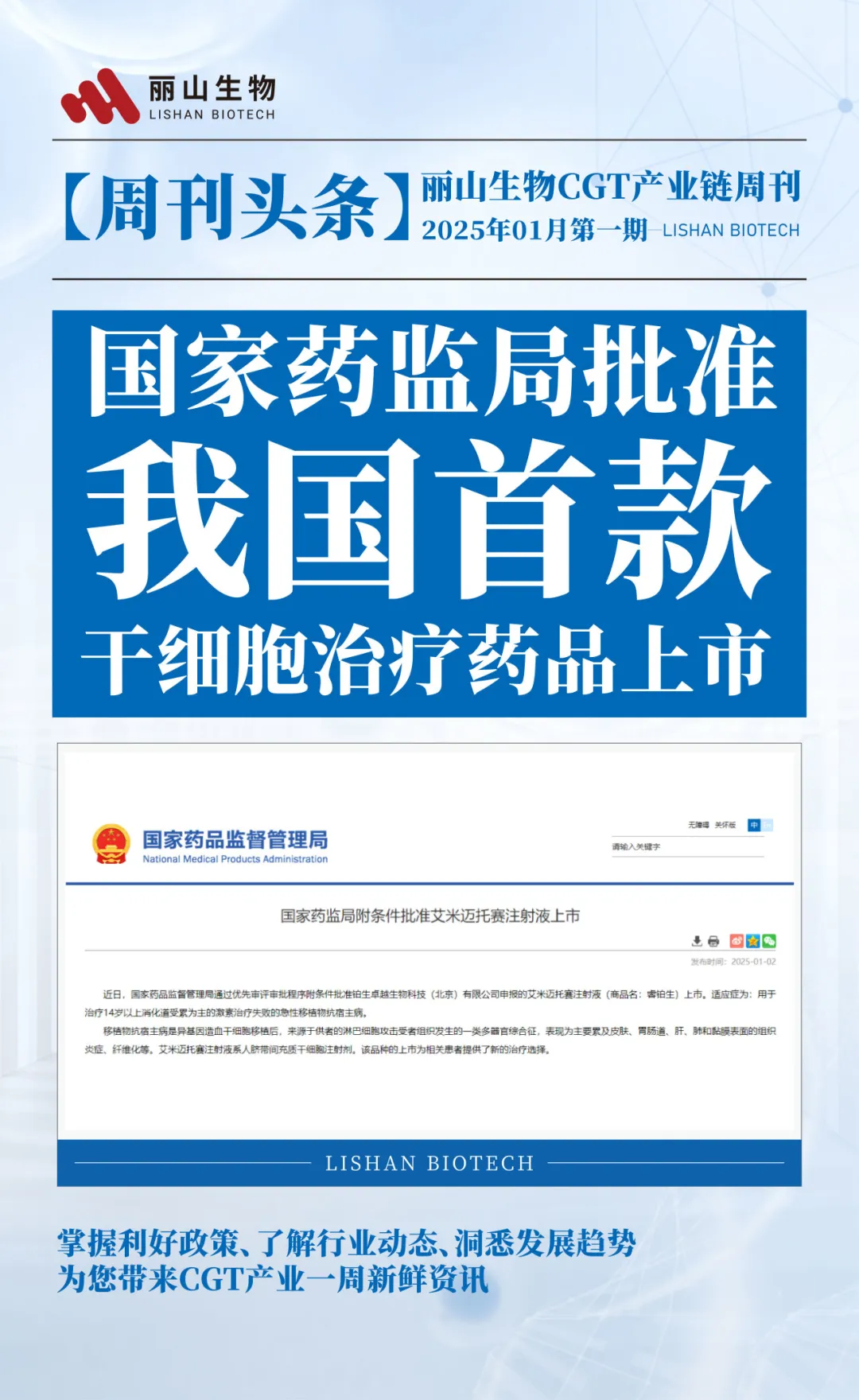
①国家药监局批准,我国首款干细胞治疗药品上市
2025年1月2日,国家药监局通过优先审评审批程序附条件批准我国首款干细胞治疗药品艾米迈托赛注射液上市,用于治疗14岁以上消化道受累为主的激素治疗失败的急性移植物抗宿主病(aGVHD)。该药品作为处方药上市,将在医院凭医生处方用于治疗相应疾病,不仅意味着移植物抗宿主病患者获得了全新的治疗方案,也意味着间充质干细胞疗法的临床应用和商业化之路由此启航,未来前景值得期待。
②5部门联合印发《北京市加快细胞与基因治疗产业创新发展三年行动方案》
2024年12月27日,北京市科学技术委员会、中关村科技园区管理委员会等5部门发布关于印发《北京市加快细胞与基因治疗产业创新发展三年行动方案》的通知。
以打造细胞与基因治疗产业创新策源地和增长极为主线,持续构建完善创新链和产业链融合的产业创新生态,不断增强北京医药健康产业高质量发展新动能。
新药进展
①星汉德生物全球首创治疗HPV病毒感染恶性肿瘤全新一代TCR-T细胞疗法IND获批
2025年1月2日,星汉德生物(SCG)宣布,国家药品监督管理局药品审评中心(NMPA)已批准其全新一代人乳头瘤病毒(HPV)特异性T细胞受体(TCR)工程化T细胞治疗——SCG142的新药临床试验(IND)申请,用于治疗HPV感染相关的恶性肿瘤,包括宫颈癌、口咽癌、头颈癌、阴道癌、外阴癌和阴茎癌等。
②靖因药业又一款siRNA疗法临床试验申报获中国药监局受理
2024年12月31日,靖因药业宣布其递交的SRSD216临床试验申请(IND)成功获得中国国家药品监督管理局药品审核中心(CDE)的受理。SRSD216是一种用于治疗高脂蛋白血症(a)的新一代siRNA疗法。
③易慕峰生物EpCAM CAR-T细胞治疗产品新增适应症IND申请获CDE受理
近日,易慕峰生物宣布其自主研发的靶向EpCAM自体CAR-T细胞注射液产品(IMC001)新增适应症的临床试验申请已获得中国国家药品监督管理局药品审评中心(CDE)受理,用于治疗上皮性晚期实体瘤。此前,IMC001已于2024年2月获得中美双报的IND批准,用于治疗EpCAM 表达阳性的晚期消化系统肿瘤。
临床研究
①全球首例!多克隆调节性T细胞(Treg)鞘内注射治疗渐冻症在郑州大学第一附属医院完成首例受试者给药
近日,由上海赛尔欣生物医疗科技有限公司(简称“赛尔欣生物”)自主研发的NP001产品在郑州大学第一附属医院完成了首例肌萎缩侧索硬化(俗称渐冻症,ALS)受试者给药。目前受试者各项指标和耐受性良好。
②科济药业宣布启动通用型CD19/CD20 CAR-T细胞疗法IIT临床试验
2024年12月31日,一家致力于血液恶性肿瘤和实体瘤治疗的创新CAR-T细胞疗法公司——科济药业,正式宣布在中国启动了一项针对复发/难治性B细胞非霍奇金淋巴瘤(R/R B-NHL)的研究者发起的临床试验(IIT)。
此次试验的候选产品为KJ-C2219,这是一款由科济药业自主研发的靶向CD19/CD20的通用型CAR-T细胞治疗产品。
③科济药业宣布Claudin18.2 CAR-T舒瑞基奥仑赛注射液中国胃癌关键II期临床试验取得初步阳性结果
2024年12月30日,科济药业宣布,关键II期临床试验CT041-ST-01(NCT04581473)已取得阳性结果。该试验是一项在中国进行的随机对照、多中心的临床试验,旨在评估舒瑞基奥仑赛注射液(研发代码:CT041,一种靶向Claudin18.2自体CAR-T细胞候选产品)治疗Claudin18.2表达阳性、既往接受过至少2线治疗失败的晚期胃/食管胃结合部腺癌的有效性和安全性,受试者以2:1的比例随机分配至舒瑞基奥仑赛注射液组或研究者选择治疗组(包括紫杉醇、多西他赛、伊立替康、阿帕替尼或纳武利尤单抗)。
④诺华 SMA 基因疗法 III 期临床成功,用于 2-18 岁人群
2024年12 月 30 日,诺华宣布一项 III 期随机、双盲、假对照 STEER 研究达到主要终点。该研究旨在评估一次性鞘内注射 Onasemnogene abeparvovec (OAV101 IT) 对未经治疗的 2 型 SMA 患者(年龄 2 至 18 岁,能够坐立但从未独立行走)的临床疗效、安全性和耐受性。根据新闻稿指出,这是首个在两岁及以上未接受治疗的 SMA 患者中具有临床获益的试验性基因疗法。
⑤赛尔欣生物多克隆调节性T细胞(Treg)鞘内注射治疗渐冻症完成首例受试者给药
2024年12月24日,由上海赛尔欣生物医疗科技有限公司自主研发的NP001产品在郑州大学第一附属医院完成了首例肌萎缩侧索硬化(俗称渐冻症,ALS)受试者给药。目前受试者各项指标和耐受性良好。


 扫一扫,关注我们
扫一扫,关注我们
