细胞治疗与大国竞争:探究中美生物医药布局及产业政策
从元宇宙到Chat-GPT人工智能的火爆出圈,科技创新正在成为驱动一个国家发展的“源动力”,谁掌握了科技“先机”,就如同把握住了发展的“命门”。
科技是中美之间最大的“战场”,而“生物技术”已成为全球地缘政治竞争的重要砝码,美国也在加大对该领域的投资和研发力度,从颁布的各种政令可以看出美国为保持“竞争优势”所做的努力,而中国作为“后起之秀”也是潜力无限。如今,中美在生物技术领域的竞争已经到了一个新阶段,这不仅关乎两国之间的科技实力,也关乎全球生命科学的未来发展。
让我们把时间线先拉回到2022年。
为减少美国在生物技术领域对中国的依赖,拜登政府签署了《国家生物技术和生物制造计划》,来“确保美国能够在国内制造于美国所发明的所有东西”。
虽然没有明确提到“中国”,但仍有不少分析表示,所谓的生物科技令,实际是继“芯片法案”后,拜登政府在高科技领域“针对中国”的又一举动。
2023年3月,作为行政令新“续集”,拜登政府颁布《美国生物技术和生物制造的明确目标》算是对去年的计划做了回应与补充,从几项“大胆”又令人震撼的数据中看得出拜登政府为始终保持“竞争优势”的决心。

△ 该文件长达64页,21个主题,49个具体目标,包含了由美国农业部、美国国立卫生研究院、国家科学基金会、能源部和国防部等机构制定的一些具体战略
·20年内用生物基替代品取代90%以上的塑料;
·通过生物制造方式满足至少30%的化学品需求;
·通过多种生物方式扩大细胞疗法规模,将成本降低10倍;
·7年内减少农业甲烷排放30%;
·5年内,对100万种微生物进行基因组测序,了解至少80%新发现基因的功能。
那么,美国缘何如此焦急又大手笔的布局生物医药?为促进生物细胞发展,美国做了哪些“大胆尝试”?中国生物科技的崛起又是怎样形成了美国新威胁?其中种种还需娓娓道来。
01
为保持“竞争优势”,
美国在生物细胞领域“大胆试错”
还记得2019年,国际干细胞协会(ISSCR)致函我国国家药品监督管理局,敦促取消卫健委新发布的一项关于“允许医疗机构的部分细胞疗法毋需通过传统的药品审核流程便可售出”的体细胞疗法的征求意见稿吗?
也许彼时的ISSCR是想打压下中国再生医学团体的激进,但现在回看来,美国的一系列操作似乎更加“大胆”,而美国在生物科技领域的“大胆”尝试也不失为细胞科技发展向前推了一把。
由于FDA政策的严苛,致使美国的许多州走上了“自治”之路,开始自设宽松的细胞政策,其中最具代表性的要属2017年6月,美国得克萨斯州率先为全球干细胞治疗政策的破冰“打响了第一枪”。
该州颁布了一项非常宽松的干细胞法案,允许该州的诊所和公司使用未经FDA审批的干细胞治疗,这意味着患者有权利自行选择是否接受干细胞治疗。

△ 得克萨斯州州长Greg Abbott宣布法案生效,率先为全球干细胞治疗政策的破冰“打响了第一枪”
法案的初衷是好的,但同样也受到了不少质疑,纽约大学生物伦理学家Beth Roxland认为,这项法案对于患者的保护可能过于笼统。
但这似乎也没有影响到法案的持续有效,为了让更多“病入膏肓”的患者拥有“第二次生命的机会”,美国政府也积极通过了一些可能有意义但同时也饱受争议的政策。
先是2015年,万众瞩目的《21世纪治愈法案》(21st Century Cures Act)在美国众议院以绝大多数赞成票表决通过。该法案旨在积极推动新药研发,加快审批过程,促进药品和医疗器械上市。

△ 美国众议院近日以344比77的投票结果轻松地通过了争论已久的“21世纪治愈法案”,它是新药开发立法的又一个里程碑,不仅进一步推动FDA对新药评审的改革,也赋予国立卫生研究院(NIH)更多的研究资源,促进基础医疗研究的发展。
虽然并非都是呼声,一些反对派指责法案可能会使一些疗法或器械在临床研究结果并不充足的前提下进入市场,为患者带来安全隐患和金钱浪费。
但不得不说,正是该法案的“大胆”尝试让生物医药达到了蓬勃顶峰,得益于此,多个治疗白血病、淋巴瘤和恶性黑色素瘤等嵌合抗原受体T细胞产品(CAR-T)获准加快临床试验进程。
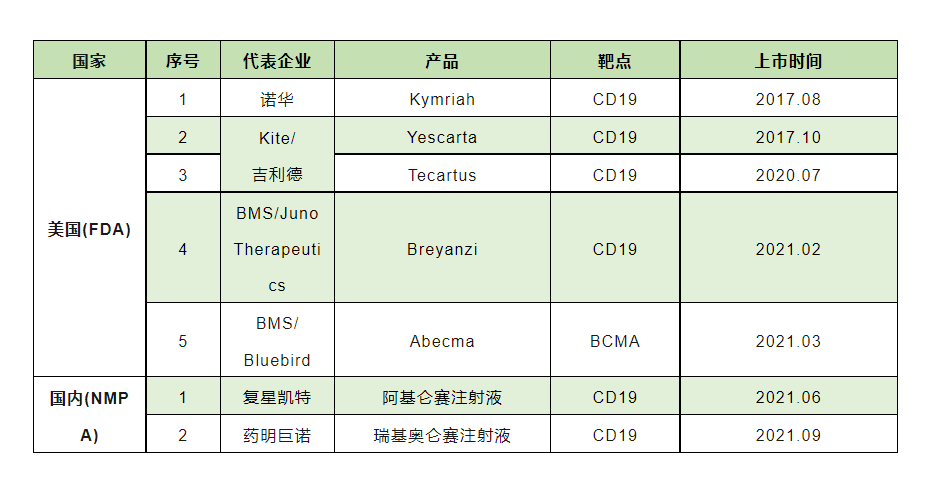
△ 目前全球已有7款CAR-T细胞治疗产品上市
更重要的是,这件事触动了FDA,为了让更多患者避免江湖骗术的蒙蔽,美国FDA在“21世纪治愈法案”的基础上设立一个名为“再生医学先进疗法(RMAT)”认证的新政策,并对符合该认证的疗法给予一系列加速审批的优惠政策。
具体来说,RMAT认定是针对再生医学疗法的药品开发审评加速程序,它允许再生医学疗法开发公司在临床试验早期更频繁地与FDA相互交流,进入该路径的RMAT产品可以申请优先审查和加速审批。
FDA生物制品评价与研究中心致力于帮助患者尽快使用上被证明安全有效的再生医学先进疗法,尤其是让患有严重或威胁生命的疾病患者尽快用上有效疗法。这也是RMAT认定的初衷。
虽然《21世纪治愈法案》不涉及监管问题,但从长远来看,RMAT认定会产生更积极和实际的影响。因为要获得RMAT认定资质,疗法必须在临床前试验中取得积极的结果,在RMAT生效的同年,FDA就已经收到了17项RMAT认定申请,其中4项已经通过了认定审批。

△ 四种产品已经获得再生医学高级疗法 (RMAT) 称号,可以更快地与该机构进行额外互动
紧接着,2018年特朗普又签署了一项“治愈法案”的姐妹篇“尝试权法案”,旨在允许患者尝试未经审批的试验药物。
或许是为了拥护特朗普政府,也或许是真的为了患者考虑,美国38个州的州议会通过类似法律,允许对病情太重、年纪太大、太年轻,或住得太远无法参与治疗的病患开立试验药物。

△ 特朗普按照竞选承诺签署通过了《乔丹法案》,允许身患绝症的晚期恶疾患者自担风险尝试未经药监部门审批的实验性治疗和药物,该法案的名字按画面中患有肌肉萎缩症的男孩乔丹命名
政策的相对宽松自然带来了细胞行业的繁荣发展,但也同样带来了治疗乱象。
在过去那几年,美国超过500家诊所从事直接面向消费者(DTC)的干细胞治疗营销,2018年1月,《新英格兰医学杂志》(NEJM)在线发表了题为“Rejuvenating Regenerative Medicine Regulation”的评述文章,抨击了美国商业干细胞治疗机构打政策擦边球,将一些未经严格的临床研究而证明安全、有效的干细胞产品用于临床治疗,并对患者造成了严重伤害。

△ 再生医学法规
为此,美国FDA针对这一乱象,制定了更细致和严格的干细胞产品监管的规范性文件,明确将干细胞产品纳入“生物类”药品进行监管和审批,从而增加了干细胞产业准入门槛。
为了继续打压和严查非法干细胞诊所,2018年“尝试权法案”后美国又相继出台了很多政策与建议用以规范干细胞疗法的使用。
寻找一种合理、有效的监管途径来规范细胞行业发展,美国算是“先行者”,可以说,美国的监管政策是从不断碰壁的乱象中走出来的,尽管目前细胞行业仍然需要更规范的标准建立,但这些大胆又充满挑战的政策确实也推动了细胞行业的发展,这一点,值得我们客观看待。
02
芯片领域后,
美国为何又瞄准了“细胞技术”?
“芯片博弈”后,“生物技术”似乎成为了新的竞逐领域,那么美国为何又瞄准了“细胞技术”呢?
作为科技发展的重要引擎之一,生物医药早已被确立为美国的支柱产业。有行业分析表明,在本世纪末之前,生物工程可能占全球制造业产出的1/3以上,价值接近30万亿美元。
此外,全球最重磅的药厂、医疗器械企业、在医学方面占据权威的高校、医院,大多数都来自美国。在行业中最权威的“诺贝尔生理医学奖”,从1910年至2018年当中216名获奖者中,99位来自美国,占总体的45.8%。足见美国在这方面的霸主地位。
这么一个庞大的行业,最有可能出现颠覆性领域是哪一块呢?答案就是细胞治疗。
干细胞连续两次被《科学》(Science)杂志列为世界十大科学问题之首,干细胞研究还在2007年和2011年获得诺贝尔生理学或医学奖。
而免疫细胞治疗领域,免疫细胞疗法正在成为攻克人类癌症的唯一有效方式,全球7款已上市的CAR-T细胞疗法,更是掀起了一波科研狂潮,缔造无数传奇治愈神话。

△ 2016年奥巴马和拜登启动“癌症登月计划”,利用免疫细胞治疗癌症曾受万人拥戴。图为 “癌症登月计划”特别工作组的第一次会议
美国FDA在几年前曾预计,“到2025年,FDA每年将批准10-20款细胞和基因疗法。”麦肯锡近期的一份报告则基于管线进展做出更大胆的预测:“仅在2024年,预计将有多达21种细胞疗法和多达31种基因疗法获得FDA批准。”
这些预言能否实现?或许这只是即将到来的浪潮的第一波。
近5年来,获得FDA批准的细胞和基因疗法数量持续增长,当前这一领域还有超过2000项临床试验正在开展,其中超过100项已迈入3期。根据公开信息,在可预见的2023年,就有多达16款全新的细胞或基因疗法有望在全球首次获批。
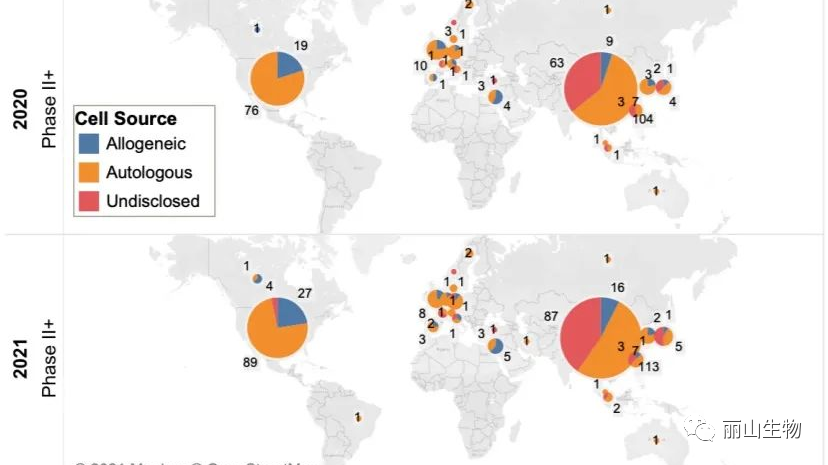
△ 全球细胞治疗药物处于 II、III 期和上市的管线分布
如此“细胞蓝海”,美国当然不想错过,正如此次拜登政府颁布的《美国生物技术和生物制造的明确目标》中明确提出的49大目标就可以看出,拜登希望通过他的新政令改变现在国内状况,呼吁对应用于制药、农业和能源领域的生物技术研究进行更有针对性的投资,以保持美国的“竞争优势”。
当然,给美国造成“新威胁”的还有中国生物技术产业的蓬勃发展。
03
美国的“新威胁”,
中国国生物技术产业正在蓬勃发展
在生物技术研发创新领域,中国的发展速度不容小觑。
近年来,中国制药行业已从生产低成本和大批量的仿制药,转向更加注重创新和研发新药。党的二十大报告将生物医药的创新,列为中国进入创新型国家的重要标志。目前,中国批准上市新药数量占全球15%左右,本土企业在研新药数量占全球33%左右。
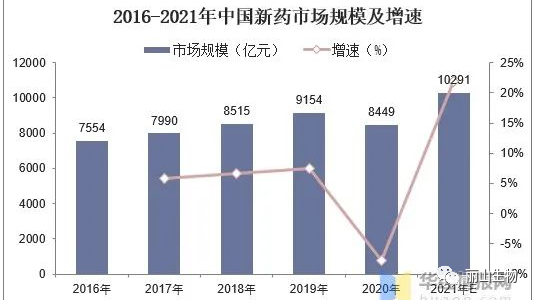
△ 2016-2020年我国新药市场规模除2020年受疫情影响之外稳定增长,2020年新药市场规模为8449亿元,2021年增长至10291亿元。
美国的多项报告也在发出“预警”,提示美国可能随时会失去领导地位,中国的生物制药业将在未来10年内有望赶超美国,成为世界最大拥有者。
从近年来我国在细胞行业颁布的政策可以看出,我国干细胞新药研发进展与监管路径的逐渐明晰,让干细胞临床转化正在迎来发展“黄金期”。
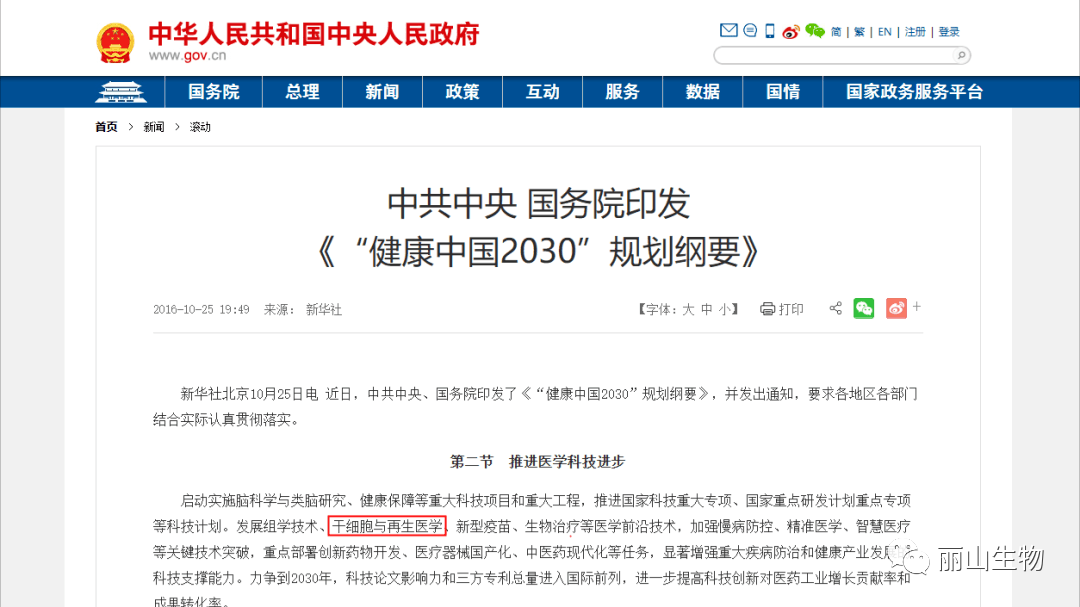
早在2016年,中共中央国务院就将细胞医学提高到了政策层面,“干细胞与再生医学”被列为国家重大科技项目写入《“健康中国2030”规划纲要》。干细胞产业甚至还被列入我国“十三五”规划、“十四五”规划的国家发展战略,这也是我国医疗科技发展的必然方向。
△ 中共中央国务院印发的《“健康中国2030”规划纲要》
在监管制度上,为鼓励干细胞产业发展,我国细胞的细胞政策实行实行“双轨制”,直接“对标”美国的“双轨制”,既可作为医疗技术申报备案,也可作为药品申请上市,为干细胞的临床转化提速。
“双轨制”指企业既可以按照2015年出台的《干细胞临床研究管理办法》,作为医疗技术向国家卫健委申报医疗机构/项目备案;也可以按照2017年发布的《药物注册管理办法(修订稿)》,作为药品(治疗用生物制品),报国家药监局申请上市。

△ 2020年8月4日,国家药品监督管理局药品审评中心组织起草了《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(征求意见稿)》,以期为药品研发注册申请人及开展药物临床试验的研究者提供更具针对性的建议和指南
在规范细胞标准化方面,2019年,我国就出台了首个干细胞通用标准——《干细胞通用要求》,为推动我国干细胞领域的规范化和标准化发展发挥重大作用。
2022年,我国又牵头制定了首个干细胞国际标准ISO 24603,以及另1项国家标准和7项团体标准,为干细胞研究、临床应用和行业发展制定了“准则”,终形成中国干细胞领域的基本共识,也是干细胞产业化的技术支撑和基础保障。
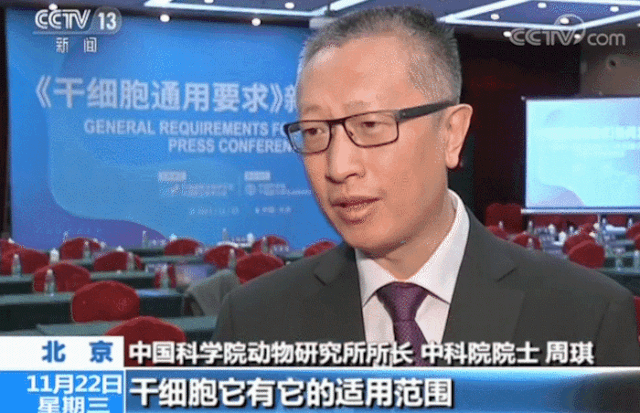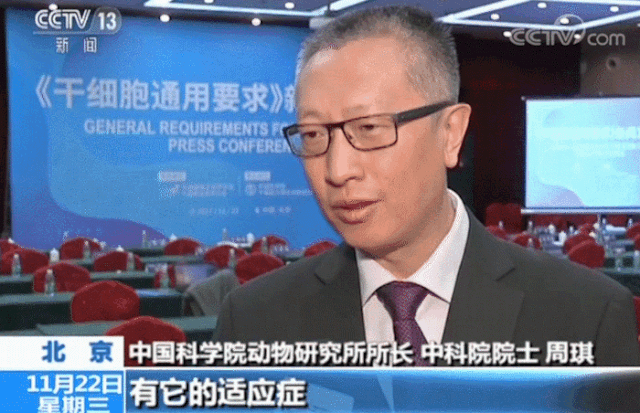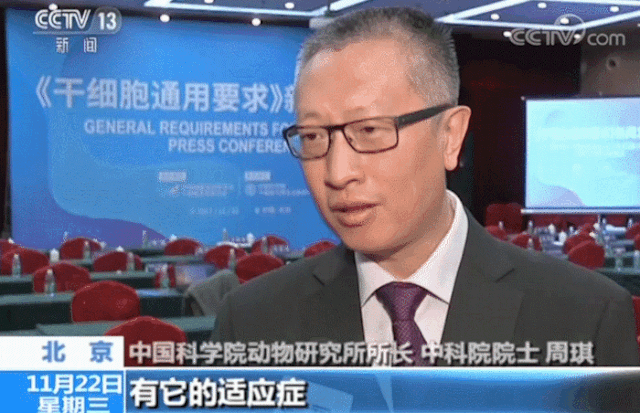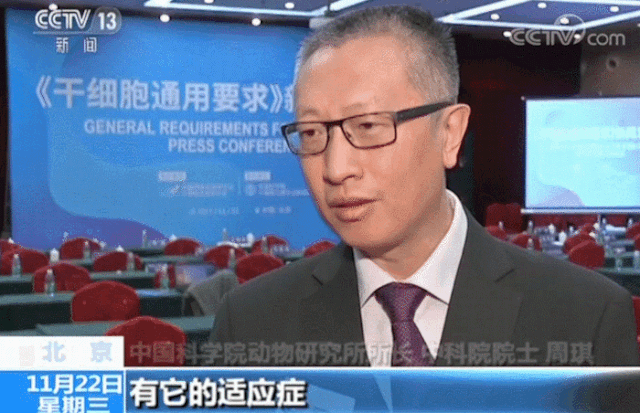
△ 中国科学院动物研究所所长、中科院院士周琪在接受记者问时表示“规范我国干细胞临床应用规范化管理及推动中国干细胞发展方面发挥重大作用”
而近年来,为大力发展生物经济,我国更是将“生物经济”提高到国家层面,列入国家发展战略写入最新《“十四五”生物经济发展规划》,寻求在未来十年超过美国的市场份额。

△ 国家发改委印发《“十四五”生物经济发展规划》的通知
国家科技部、卫健委、发改委、药监局等九部联合印发《“十四五”医药工业发展规划》,明确将免疫细胞治疗、干细胞治疗、基因治疗产品等纳入规划内容,自此,干细胞正式被写入我国第十四个五年规划和2035年愿景目标中,可见,国家对细胞行业的重视程度。
新兴产业的发展当然也离不开政府资金的支持,3年以来,“干细胞及转化研究”重点专项连续3年获得中央财政资助,总计超过20亿元,在资金上可谓给足了“马力”。
△ 科技部发布《“干细胞及转化研究”等重点专项2020年度项目申报指南的通知》,仅2020年,国拨总经费2.40亿元
或许在化药研发方面,中国依然有落后于欧美发达国家,但干细胞却是我国少有的在全球处于“并跑”地位的领域之一,是赶超国际,引领医疗趋势,对标中国位置的全新领域,可以说,中国干细胞技术已处于世界领先水平。
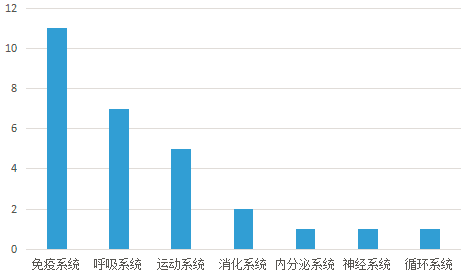
△ 中国已获准开展IND的干细胞药物数量的适应症范围分布。从临床备案数量及申报药品数量上来看,在全球范围内,中国与美国居于前列,欧盟紧随其后。
当然,作为细胞治疗的“新宠儿”,中国的免疫细胞治疗也在2021年迎来了里程碑式发展。2款CAR-T细胞疗法的上市填补了国内空白,也打消了从业者对细胞能否成药的政策疑虑。
这也直接触发了国内细胞疗法“井喷式”爆发增长,中国开展的CAR-T细胞产品临床试验数量为全球第一,直接“比肩”美国,与美国呈“双雄争霸”的格局。
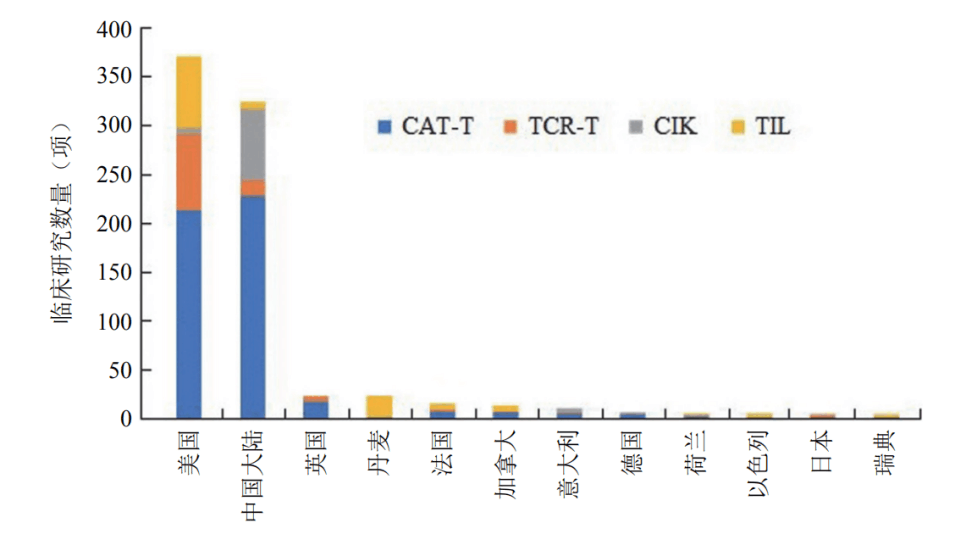
△ 以 CAR-T、TCR-T、TIL 和CIK这四种常见的免疫细胞疗法为例,美国和中国的临床研究规模远超过其他国家,而中国以接近40%的年平均增长,不容小觑。
干细胞、免疫细胞治疗都在与美国抢占市场,而比起美国的大刀阔斧,或许中国的稳中求进更像是一只闷头前进的“雄狮”,不可估量的爆发力更让人心生畏惧。
纵观我国细胞治疗政策,可以说是经历了从松到紧,从宽到严的一个循序渐进过程,虽然没有美国如此大胆尝试,但作为一项关乎人类命运的新技术,也值得更多细致入微的变革,从以稳妥为主到如今干细胞治疗总体步入“快车道”,并入国家发展规划,可以看出我国细胞治疗正向着更加规范化、更加长远的利于临床转化的方向发展。
而从更大的外部环境来看,人口老龄化、肿瘤年轻化,以及流行病毒持续反复肆虐的“助推”之下,中国细胞治疗在肿瘤新药研发、个体化医疗、精准医疗和再生医学等领域的应用价值和地位也在不断提升。
当然,我们也应该看到,中国的生物技术企业面临着来自美国公司的竞争和巨大压力,尽管我们在创新和成本控制方面取得了很大进步,但仍需更多的时间和资源与美国甚至世界竞争。生物技术的发展需要高度的规制和伦理标准,这是一项能够改变人类未来健康与福祉的领域,因此,中国的生物技术公司也需要投入更多资源和精力历来应对这些挑战。
显而易见的是,中国想要在全球拥有更多话语权,仍需不断奋进。
Write in the last
写在最后
声明:
本站发布的内容重在分享,如有侵权请联系我们,我们将会处理。
本文章来源于华夏源干细胞


 扫一扫,关注我们
扫一扫,关注我们
