锚定政策新机遇:丽山生物CDMO中试基地凭实力圈粉
2025年9月,国务院颁布第818号国务院令《生物医学新技术临床研究和临床转化应用管理条例》(以下简称《条例》),自2026年5月1日起施行。作为生物医学新技术领域的“基本法”,《条例》明确了临床研究与转化应用的规范路径,标志着我国细胞与基因治疗(CGT)等前沿领域迈入规范化、高质量发展新阶段。在此政策东风下,丽山生物以前瞻性布局与深厚积淀,凸显三大核心优势,助力合作伙伴精准把握时代机遇。
▲示意图 | 来源网络
1
合规先行:
契合政策监管要求的全链条资质保障
《条例》构建了从临床前研究到转化应用的全流程监管体系,明确要求生物医学新技术的研究与转化需具备科学依据、合规资质及完善的质量安全管理机制。丽山生物的合规能力与政策要求高度契合,形成天然优势。
(一)省级认证平台的资质硬支撑
《条例》强调临床研究与转化需依托具备专业能力的合规载体,丽山生物的免疫细胞与基因治疗CDMO中试基地作为山东省首家由省科技厅认可的专业平台,从设立之初便遵循严苛的合规标准。基地不仅通过多项行业权威认证,更构建了与《条例》要求适配的全流程管理体系,能够为合作伙伴提供符合政策导向的中试服务,从根本上解决了基础实验室成果向临床转化中合规性障碍。

▲实景图 | 山东省免疫细胞与基因治疗CDMO中试基地
(二)GMP 级质量体系的全流程覆盖
《条例》要求临床研究中使用的相关产品需符合药品、医疗器械监管规定,且研究记录需留存30年以上(涉及子代的永久保存)。丽山生物质量与检测中心以GMP为核心,打造“全流程规范+全环节检验” 的双擎质量平台,自主研发40余项检验技术,建立从原料入厂到中试产品放行的全链条追溯体系。这种合规能力不仅满足《条例》对数据完整性、可追溯性的要求,更能为后续临床申报提供符合标准的资质文件与研究数据,加速备案与审批进程。
2
技术适配:
破解政策导向下的转化核心痛点
《条例》明确提出“促进生物医学新技术创新发展,鼓励临床转化应用”,同时强调需具备“充足科学依据”和“经非临床研究证明安全有效”的前提条件。丽山生物的核心技术能力精准匹配政策对“转化有效性”的核心要求,破解行业痛点。
(一)中试转化能力衔接政策全链条路径
《条例》清晰界定了“临床前研究-临床研究-转化应用”的衔接路径,其中中试转化是连接基础实验室成果与临床研究的关键枢纽。丽山生物构建的“研发-中试-生产-应用”全链条服务体系,恰好覆盖政策规定的核心转化环节:针对基础实验室的早期技术,可提供工艺优化、小试放大服务;进入临床研究阶段,能完成符合GMP标准的中试样品生产;后续更可支撑商业化生产,实现“一次合作、全流程落地”,完美契合政策对提高转化效率的要求。

▲实景图 | 山东省免疫细胞与基因治疗CDMO中试基地
(二)高成熟度技术保障转化科学性
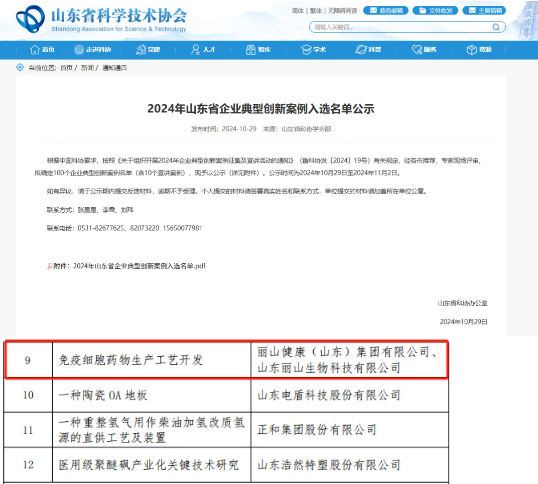
《条例》要求生物医学新技术的研究需具备坚实的科学基础与实践验证。丽山生物的核心工艺均经过中试验证,能够为转化的“科学性”与“安全性”提供数据支撑:其研发的质粒制备工艺经中试验证,产量翻倍且成本减半,入选山东省企业典型创新案例;NK细胞编辑率提升至97%,CAR-T细胞活性稳定在 95%以上,相关技术达“国际先进水平”。这些经实践验证的技术成果,能确保基础实验室的创新想法转化为符合政策要求的“安全有效”的中试产品,大幅降低临床研究风险。
▲示意图 | 来源网络
3
生态适配:
匹配政策产业升级的资源整合能力
《条例》通过明确准入标准与监管规范,推动行业资源向高质量机构集中,加速产业生态升级。丽山生物的资源配置与生态布局,正顺应这一政策导向,形成差异化优势。
(一)产业级硬件满足规模化转化需求
《条例》落地后,临床研究与转化对产能规模、设备标准的要求显著提升。丽山生物投入超1.亿元打造产业级硬件集群,配备Cytiva(思拓凡)先进发酵系统、赛多利斯纯化设备等600余台套国际尖端设备,6500平方米的CDMO中试基地可实现质粒克级产量规模化生产。这种硬件配置不仅远超基础实验室的小型化设备局限,更能满足政策引导下“规模化、标准化”的转化趋势,为多批次临床样品生产与商业化提供保障。

▲实景图 | 山东省免疫细胞与基因治疗CDMO中试基地
(二)复合型人才团队契合政策资质要求
《条例》对临床研究人员的资质、专业能力提出严格要求,强调“具备相应经验与能力”。丽山生物组建的四大攻坚团队,95%成员为硕博学历,均来自中科院、山东大学等重点院校,曾参与国家重点研发计划等重大课题。团队兼具基础研究功底与中试产业化经验,既能理解基础实验室的技术逻辑,又能精准把握临床转化与合规申报的要求,这支兼具前沿科研视野与产业化实战经验的复合型团队,构成了丽山生物难以被复制的核心人才壁垒。
结语:
政策东风下的转化优选伙伴
818号国务院令的出台,为生物医学新技术产业划定了“合规发展、高效转化”的明确航向。丽山生物凭借省级合规平台资质、全链条技术转化能力、产业级资源生态三大核心优势,不仅完全契合政策对“安全、合规、有效”的核心要求,更能帮助合作伙伴加速从基础实验室到临床应用的转化进程,降低政策适应成本。
在政策驱动产业升级的关键期,选择丽山生物CDMO中试基地,不仅是选择与政策同频、与市场同步的专业伙伴,更是选择打通创新成果转化“最后一公里”的最优路径。


 扫一扫,关注我们
扫一扫,关注我们
